Innen moderne medisin har antibiotika vist seg å være et av de viktigste fremskrittene, og har dramatisk redusert forekomsten og dødeligheten forbundet med mikrobielle infeksjoner. Deres evne til å endre de kliniske utfallene av bakterielle infeksjoner har forlenget forventet levealder for utallige pasienter. Antibiotika er avgjørende i komplekse medisinske prosedyrer, inkludert kirurgi, implantatplasseringer, transplantasjoner og cellegiftbehandling. Fremveksten av antibiotikaresistente patogener har imidlertid vært en økende bekymring, noe som reduserer effekten av disse legemidlene over tid. Forekomster av antibiotikaresistens har blitt dokumentert på tvers av alle kategorier av antibiotika etter hvert som mikrobielle mutasjoner oppstår. Seleksjonspresset som utøves av antimikrobielle legemidler har bidratt til økningen av resistente stammer, noe som utgjør en betydelig utfordring for global helse.
For å bekjempe det presserende problemet med antimikrobiell resistens er det viktig å implementere effektive smitteverntiltak som begrenser spredningen av resistente patogener, samtidig som det reduserer bruken av antibiotika. Videre er det et presserende behov for alternative behandlingsmetoder. Hyperbarisk oksygenbehandling (HBOT) har dukket opp som en lovende metode i denne sammenhengen, og involverer inhalering av 100 % oksygen ved spesifikke trykknivåer over en periode. HBOT, som enten er en primær eller komplementær behandling for infeksjoner, kan gi nytt håp for behandling av akutte infeksjoner forårsaket av antibiotikaresistente patogener.
Denne terapien brukes i økende grad som en primær eller alternativ behandling for ulike tilstander, inkludert betennelse, karbonmonoksidforgiftning, kroniske sår, iskemiske sykdommer og infeksjoner. De kliniske anvendelsene av HBOT i infeksjonsbehandling er omfattende og gir uvurderlige fordeler for pasienter.

Kliniske anvendelser av hyperbarisk oksygenbehandling ved infeksjon
Nåværende bevis støtter robust bruken av HBOT, både som frittstående og tilleggsbehandling, og gir betydelige fordeler for infiserte pasienter. Under HBOT kan det arterielle oksygentrykket i blodet stige til 2000 mmHg, og den resulterende høye oksygen-vevstrykkgradienten kan øke oksygennivået i vevet til 500 mmHg. Slike effekter er spesielt verdifulle for å fremme helbredelse av inflammatoriske responser og mikrosirkulasjonsforstyrrelser observert i iskemiske miljøer, samt for å håndtere kompartmentsyndrom.
HBOT kan også påvirke tilstander som er avhengige av immunsystemet. Forskning indikerer at HBOT kan undertrykke autoimmune syndromer og antigeninduserte immunresponser, noe som bidrar til å opprettholde transplantattoleranse ved å redusere sirkulasjonen av lymfocytter og leukocytter samtidig som det modulerer immunresponser. I tillegg kan HBOTstøtter helbredelsei kroniske hudlesjoner ved å stimulere angiogenese, en kritisk prosess for forbedret rekonvalesens. Denne behandlingen oppmuntrer også til dannelsen av kollagenmatriks, en viktig fase i sårheling.
Spesiell oppmerksomhet må rettes mot visse infeksjoner, spesielt dype og vanskelig behandlede infeksjoner som nekrotiserende fasciitt, osteomyelitt, kroniske bløtvevsinfeksjoner og infeksiøs endokarditt. En av de vanligste kliniske bruksområdene for HBOT er for hud-bløtvevsinfeksjoner og osteomyelitt assosiert med lave oksygennivåer som ofte er forårsaket av anaerobe eller resistente bakterier.
1. Diabetiske fotinfeksjoner
Diabetisk fotSår er en vanlig komplikasjon blant diabetespasienter, og rammer opptil 25 % av denne befolkningen. Infeksjoner oppstår ofte i disse sårene (utgjør 40–80 % av tilfellene) og fører til økt sykelighet og dødelighet. Diabetiske fotinfeksjoner (DFI) består vanligvis av polymikrobielle infeksjoner med en rekke identifiserte anaerobe bakterielle patogener. Ulike faktorer, inkludert defekter i fibroblastfunksjonen, problemer med kollagendannelse, cellulære immunmekanismer og fagocyttfunksjon, kan hindre sårheling hos diabetespasienter. Flere studier har identifisert nedsatt hudoksygenering som en sterk risikofaktor for amputasjoner relatert til DFI.
Som et av de nåværende alternativene for DFI-behandlingDet er rapportert at HBOT forbedrer helbredelsesraten for diabetiske fotsår betydelig, noe som reduserer behovet for amputasjoner og kompliserte kirurgiske inngrep. Det minimerer ikke bare behovet for ressurskrevende prosedyrer, som fotklaffkirurgi og hudtransplantasjon, men gir også lavere kostnader og minimale bivirkninger sammenlignet med kirurgiske alternativer. En studie av Chen et al. viste at mer enn 10 økter med HBOT førte til en forbedring på 78,3 % i sårtilhelingsrater hos diabetespasienter.
2. Nekrotiserende bløtvevsinfeksjoner
Nekrotiserende bløtvevsinfeksjoner (NSTI-er) er ofte polymikrobielle, vanligvis forårsaket av en kombinasjon av aerobe og anaerobe bakterielle patogener, og er ofte forbundet med gassproduksjon. Selv om NSTI-er er relativt sjeldne, har de en høy dødelighet på grunn av rask progresjon. Rettidig og passende diagnose og behandling er nøkkelen til å oppnå gunstige resultater, og HBOT har blitt anbefalt som en tilleggsmetode for behandling av NSTI-er. Selv om det fortsatt er uenighet om bruken av HBOT ved NSTI-er på grunn av mangelen på prospektive kontrollerte studier,bevis tyder på at det kan være korrelert med forbedret overlevelse og organbevaring hos NSTI-pasienterEn retrospektiv studie indikerte en signifikant reduksjon i dødelighet blant NSTI-pasienter som fikk HBOT.
1.3 Infeksjoner på operasjonsstedet
SSI-er kan klassifiseres basert på infeksjonens anatomiske sted og kan oppstå fra ulike patogener, inkludert både aerobe og anaerobe bakterier. Til tross for fremskritt innen infeksjonskontrolltiltak, som steriliseringsteknikker, bruk av profylaktiske antibiotika og forbedringer i kirurgisk praksis, er SSI-er fortsatt en vedvarende komplikasjon.
En betydelig oversiktsartikkel har undersøkt effekten av HBOT i å forebygge dype infeksjoner i innleggelsen (SSI) ved nevromuskulær skoliosekirurgi. Preoperativ HBOT kan redusere forekomsten av SSI-er betydelig og legge til rette for sårtilheling. Denne ikke-invasive behandlingen skaper et miljø der oksygennivået i sårvevet er forhøyet, noe som har vært assosiert med den oksidative drepende virkningen mot patogener. I tillegg adresserer den de reduserte blod- og oksygennivåene som bidrar til utviklingen av SSI-er. Utover andre infeksjonskontrollstrategier har HBOT blitt anbefalt spesielt for rent forurensede kirurgiske inngrep, som kolorektale prosedyrer.
1.4 Brannskader
Brannskader er skader forårsaket av ekstrem varme, elektrisk strøm, kjemikalier eller stråling, og kan føre til høy sykelighet og dødelighet. HBOT er gunstig i behandling av brannskader ved å øke oksygennivået i skadet vev. Mens dyre- og kliniske studier viser blandede resultater angåendeEffektiviteten av HBOT i behandling av brannskader, en studie med 125 brannskadepasienter indikerte at HBOT ikke viste noen signifikant innvirkning på dødelighet eller antall utførte operasjoner, men reduserte gjennomsnittlig helbredelsestid (19,7 dager sammenlignet med 43,8 dager). Integrering av HBOT med omfattende brannskadebehandling kan effektivt kontrollere sepsis hos brannskadepasienter, noe som fører til kortere helbredelsestider og redusert væskebehov. Imidlertid er det behov for ytterligere omfattende prospektiv forskning for å bekrefte rollen til HBOT i behandlingen av omfattende brannskader.
1.5 Osteomyelitt
Osteomyelitt er en infeksjon i bein eller beinmarg, ofte forårsaket av bakterielle patogener. Behandling av osteomyelitt kan være utfordrende på grunn av den relativt dårlige blodtilførselen til bein og den begrensede penetrasjonen av antibiotika i margen. Kronisk osteomyelitt er karakterisert av vedvarende patogener, mild betennelse og nekrotisk beinvevsdannelse. Refraktær osteomyelitt refererer til kroniske beininfeksjoner som fortsetter eller kommer tilbake til tross for passende behandling.
HBOT har vist seg å forbedre oksygennivåene i infisert beinvev betydelig. Tallrike kasus- og kohortstudier indikerer at HBOT forbedrer kliniske utfall for pasienter med osteomyelitt. Det ser ut til å virke gjennom ulike mekanismer, inkludert å øke metabolsk aktivitet, undertrykke bakterielle patogener, forbedre antibiotikaeffekten, minimere betennelse og fremme helbredelse.prosesser. Etter HBOT viser 60 % til 85 % av pasienter med kronisk, refraktær osteomyelitt tegn på infeksjonsundertrykkelse.
1.6 Soppinfeksjoner
Globalt lider over tre millioner individer av kroniske eller invasive soppinfeksjoner, noe som fører til over 600 000 dødsfall årlig. Behandlingsresultatene for soppinfeksjoner blir ofte svekket på grunn av faktorer som endret immunstatus, underliggende sykdommer og patogeners virulensegenskaper. HBOT er i ferd med å bli et attraktivt terapeutisk alternativ ved alvorlige soppinfeksjoner på grunn av sin sikkerhet og ikke-invasive natur. Studier indikerer at HBOT kan være effektivt mot sopppatogener som Aspergillus og Mycobacterium tuberculosis.
HBOT fremmer soppdrepende effekter ved å hemme biofilmdannelsen til Aspergillus, med økt effektivitet observert i stammer som mangler superoksiddismutase (SOD)-gener. De hypoksiske forholdene under soppinfeksjoner utgjør utfordringer for tilførsel av soppdrepende legemidler, noe som gjør de økte oksygennivåene fra HBOT til et potensielt gunstig intervensjon, selv om ytterligere forskning er berettiget.
De antimikrobielle egenskapene til HBOT
Det hyperoksiske miljøet som skapes av HBOT initierer fysiologiske og biokjemiske endringer som stimulerer antibakterielle egenskaper, noe som gjør det til en effektiv tilleggsbehandling for infeksjoner. HBOT viser bemerkelsesverdige effekter mot aerobe bakterier og hovedsakelig anaerobe bakterier gjennom mekanismer som direkte bakteriedrepende aktivitet, forsterkning av immunresponser og synergistiske effekter med spesifikke antimikrobielle midler.
2.1 Direkte antibakterielle effekter av HBOT
Den direkte antibakterielle effekten av HBOT tilskrives i stor grad genereringen av reaktive oksygenarter (ROS), som inkluderer superoksidanioner, hydrogenperoksid, hydroksylradikaler og hydroksylioner – som alle oppstår under cellulær metabolisme.
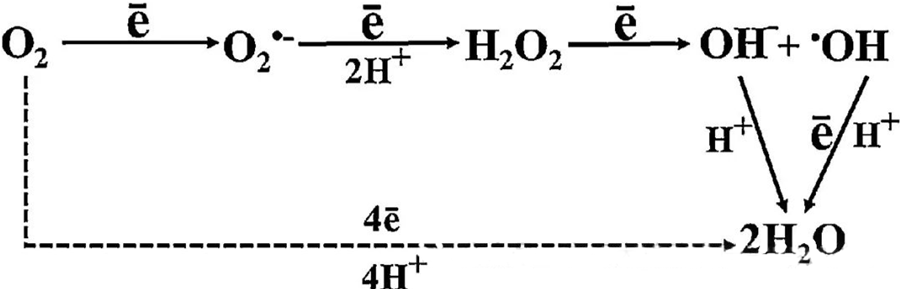
Samspillet mellom O₂ og cellulære komponenter er viktig for å forstå hvordan ROS dannes i celler. Under visse forhold, kalt oksidativt stress, forstyrres balansen mellom ROS-dannelse og nedbrytning, noe som fører til forhøyede nivåer av ROS i celler. Produksjonen av superoksid (O₂⁻) katalyseres av superoksiddismutase, som deretter omdanner O₂⁻ til hydrogenperoksid (H₂O₂). Denne omdannelsen forsterkes ytterligere av Fenton-reaksjonen, som oksiderer Fe²⁺ for å generere hydroksylradikaler (·OH) og Fe³⁺, og dermed initierer en skadelig redokssekvens med ROS-dannelse og celleskade.
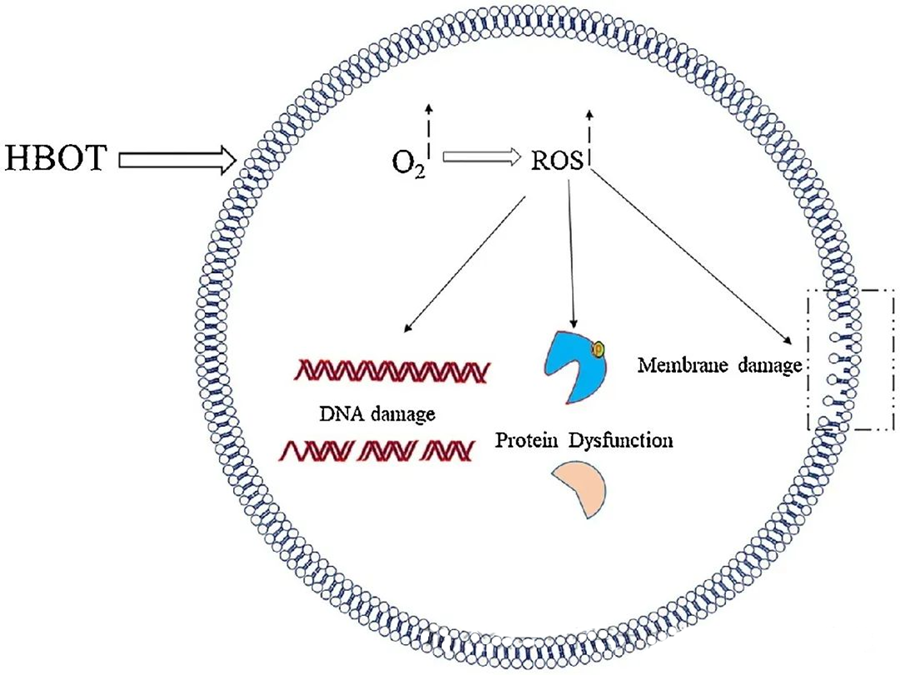
De toksiske effektene av ROS retter seg mot kritiske cellulære komponenter som DNA, RNA, proteiner og lipider. Det er verdt å merke seg at DNA er et primært mål for H₂O₂-mediert cytotoksisitet, ettersom det forstyrrer deoksyribosestrukturer og skader basesammensetninger. Den fysiske skaden indusert av ROS strekker seg til helixstrukturen til DNA, potensielt som følge av lipidperoksidasjon utløst av ROS. Dette understreker de negative konsekvensene av forhøyede ROS-nivåer i biologiske systemer.
Antimikrobiell virkning av ROS
ROS spiller en viktig rolle i å hemme mikrobiell vekst, noe som er demonstrert gjennom HBOT-indusert ROS-generering. De toksiske effektene av ROS retter seg direkte mot cellulære bestanddeler som DNA, proteiner og lipider. Høye konsentrasjoner av aktive oksygenforbindelser kan direkte skade lipider, noe som fører til lipidperoksidasjon. Denne prosessen kompromitterer integriteten til cellemembraner og følgelig funksjonaliteten til membranassosierte reseptorer og proteiner.
Videre gjennomgår proteiner, som også er viktige molekylære mål for ROS, spesifikke oksidative modifikasjoner ved forskjellige aminosyrerester som cystein, metionin, tyrosin, fenylalanin og tryptofan. For eksempel har HBOT vist seg å indusere oksidative endringer i flere proteiner i E. coli, inkludert elongasjonsfaktor G og DnaK, og dermed påvirke deres cellulære funksjoner.
Styrking av immunitet gjennom HBOT
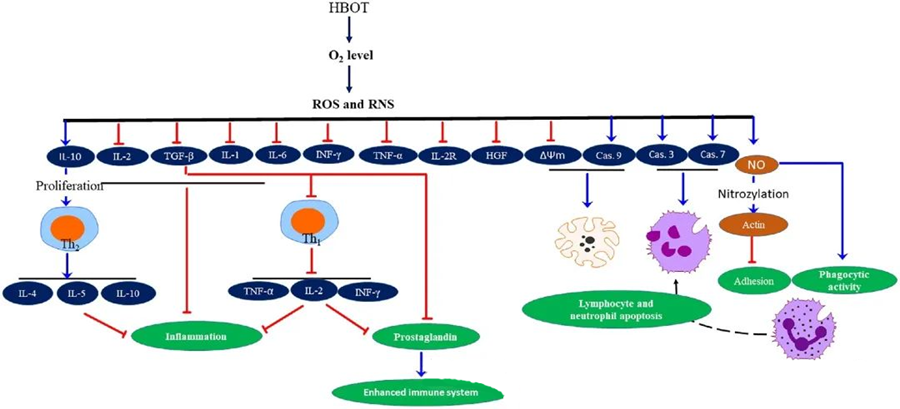
De antiinflammatoriske egenskapene til HBOThar blitt dokumentert, noe som har vist seg å være avgjørende for å lindre vevsskade og undertrykke infeksjonsprogresjon. HBOT påvirker uttrykket av cytokiner og andre inflammatoriske regulatorer betydelig, og påvirker immunresponsen. Ulike eksperimentelle systemer observerte forskjellige endringer i genuttrykk og proteingenerering etter HBOT, som enten oppregulerer eller nedregulerer vekstfaktorer og cytokiner.
Under HBOT-prosessen utløser økte O₂-nivåer en rekke cellulære responser, som å undertrykke frigjøringen av proinflammatoriske mediatorer og fremme lymfocytt- og nøytrofil-apoptose. Samlet sett forsterker disse handlingene immunsystemets antimikrobielle mekanismer, og letter dermed helbredelsen av infeksjoner.
Videre tyder studier på at økte O₂-nivåer under HBOT kan redusere uttrykket av proinflammatoriske cytokiner, inkludert interferon-gamma (IFN-γ), interleukin-1 (IL-1) og interleukin-6 (IL-6). Disse endringene inkluderer også nedregulering av forholdet mellom CD4:CD8 T-celler og modulering av andre løselige reseptorer, noe som til slutt øker interleukin-10 (IL-10)-nivåene, noe som er avgjørende for å motvirke betennelse og fremme helbredelse.
De antimikrobielle aktivitetene til HBOT er sammenvevd med komplekse biologiske mekanismer. Både superoksid og forhøyet trykk har vist seg å inkonsekvent fremme HBOT-indusert antibakteriell aktivitet og nøytrofil-apoptose. Etter HBOT øker en markant økning i oksygennivåer de bakteriedrepende egenskapene til nøytrofiler, en essensiell komponent i immunresponsen. Videre undertrykker HBOT nøytrofil-adhesjon, som medieres av interaksjonen mellom β-integriner på nøytrofiler med intercellulære adhesjonsmolekyler (ICAM) på endotelceller. HBOT hemmer aktiviteten til nøytrofil β-2-integrin (Mac-1, CD11b/CD18) gjennom en nitrogenoksid (NO)-mediert prosess, noe som bidrar til migrasjonen av nøytrofiler til infeksjonsstedet.
Den nøyaktige omorganiseringen av cytoskjelettet er nødvendig for at nøytrofiler effektivt skal kunne fagocytisere patogener. S-nitrosylering av aktin har vist seg å stimulere aktinpolymerisering, noe som potensielt letter den fagocytiske aktiviteten til nøytrofiler etter HBOT-forbehandling. Dessuten fremmer HBOT apoptose i humane T-cellelinjer gjennom mitokondrielle signalveier, med rapporter om akselerert lymfocyttdød etter HBOT. Blokkering av caspase-9 – uten å påvirke caspase-8 – har vist de immunmodulerende effektene av HBOT.
De synergistiske effektene av HBOT med antimikrobielle midler
I kliniske anvendelser brukes HBOT ofte sammen med antibiotika for å bekjempe infeksjoner effektivt. Den hyperoksiske tilstanden som oppnås under HBOT kan påvirke effekten av visse antibiotika. Forskning tyder på at spesifikke bakteriedrepende legemidler, som β-laktamer, fluorokinoloner og aminoglykosider, ikke bare virker gjennom iboende mekanismer, men også delvis er avhengige av bakteriens aerobe metabolisme. Derfor er tilstedeværelsen av oksygen og de metabolske egenskapene til patogener avgjørende når man evaluerer de terapeutiske effektene av antibiotika.
Betydelig bevis har vist at lave oksygennivåer kan øke Pseudomonas aeruginosas resistens mot piperacillin/tazobaktam, og at et miljø med lavt oksygeninnhold også bidrar til økt resistens hos Enterobacter cloacae mot azitromycin. Omvendt kan visse hypoksiske tilstander øke bakteriell følsomhet for tetracyklin-antibiotika. HBOT fungerer som en levedyktig tilleggsbehandlingsmetode ved å indusere aerob metabolisme og reoksygenere hypoksisk infisert vev, noe som deretter øker patogeners følsomhet for antibiotika.
I prekliniske studier reduserte kombinasjonen av HBOT – administrert to ganger daglig i 8 timer ved 280 kPa – sammen med tobramycin (20 mg/kg/dag) betydelig bakteriemengden ved Staphylococcus aureus infeksiøs endokarditt. Dette demonstrerer potensialet til HBOT som en tilleggsbehandling. Ytterligere undersøkelser har vist at under 37 °C og 3 ATA-trykk i 5 timer forsterket HBOT effekten av imipenem mot makrofaginfisert Pseudomonas aeruginosa betydelig. I tillegg ble den kombinerte modaliteten av HBOT med cefazolin funnet å være mer effektiv i behandling av Staphylococcus aureus osteomyelitt i dyremodeller sammenlignet med cefazolin alene.
HBOT øker også den bakteriedrepende effekten av ciprofloksacin mot Pseudomonas aeruginosa-biofilmer betydelig, spesielt etter 90 minutters eksponering. Denne forbedringen tilskrives dannelsen av endogene reaktive oksygenarter (ROS) og viser økt følsomhet hos peroksidase-defekte mutanter.
I modeller av pleuritt forårsaket av meticillinresistente Staphylococcus aureus (MRSA), viste den samarbeidende effekten av vankomycin, teikoplanin og linezolid med HBOT signifikant økt effekt mot MRSA. Metronidazol, et antibiotikum som er mye brukt i behandling av alvorlige anaerobe og polymikrobielle infeksjoner som diabetiske fotinfeksjoner (DFIs) og infeksjoner i kirurgiske sår (SSIs), har vist høyere antimikrobiell effektivitet under anaerobe forhold. Fremtidige studier er berettiget til å utforske de synergistiske antibakterielle effektene av HBOT kombinert med metronidazol i både in vivo- og in vitro-settinger.
Den antimikrobielle effekten av HBOT på resistente bakterier
Med utviklingen og spredningen av resistente stammer mister tradisjonelle antibiotika ofte sin styrke over tid. Videre kan HBOT vise seg å være essensielt i behandling og forebygging av infeksjoner forårsaket av multiresistente patogener, og tjene som en kritisk strategi når antibiotikabehandlinger mislykkes. Tallrike studier har rapportert de betydelige bakteriedrepende effektene av HBOT på klinisk relevante resistente bakterier. For eksempel reduserte en 90-minutters HBOT-økt ved 2 ATM veksten av MRSA betydelig. I tillegg har HBOT i forholdsmodeller forsterket de antibakterielle effektene av ulike antibiotika mot MRSA-infeksjoner. Rapporter har bekreftet at HBOT er effektivt i behandling av osteomyelitt forårsaket av OXA-48-produserende Klebsiella pneumoniae uten at det er nødvendig med tilleggsantibiotika.
Oppsummert representerer hyperbarisk oksygenbehandling en mangesidig tilnærming til infeksjonskontroll, som forbedrer immunresponsen samtidig som den forsterker effekten av eksisterende antimikrobielle midler. Med omfattende forskning og utvikling har den potensial til å redusere effektene av antibiotikaresistens, noe som gir håp i den pågående kampen mot bakterielle infeksjoner.
Publisert: 28. feb. 2025

