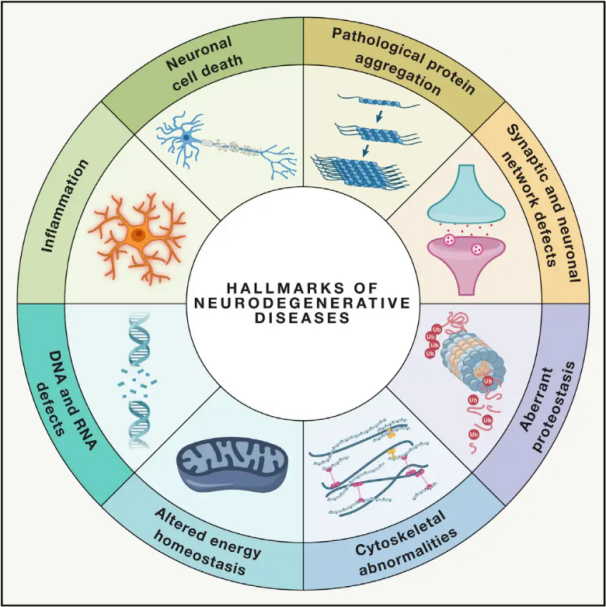
Nevrodegenerative sykdommer(NDD-er) kjennetegnes av progressivt eller vedvarende tap av spesifikke sårbare nevronpopulasjoner i hjernen eller ryggmargen. Klassifiseringen av NDD-er kan være basert på ulike kriterier, inkludert den anatomiske fordelingen av nevrodegenerasjon (som ekstrapyramidale lidelser, frontotemporal degenerasjon eller spinocerebellar ataksier), primære molekylære abnormaliteter (som amyloid-β, prioner, tau eller α-synuklein), eller viktige kliniske trekk (som Parkinsons sykdom, amyotrofisk lateral sklerose og demens). Til tross for disse forskjellene i klassifisering og symptompresentasjon, deler lidelser som Parkinsons sykdom (PD), amyotrofisk lateral sklerose (ALS) og Alzheimers sykdom (AD) felles underliggende prosesser som fører til nevronal dysfunksjon og til slutt celledød.
Med millioner av mennesker verden over rammet av ikke-degenerative sykdommer (NDDs), anslår Verdens helseorganisasjon at disse sykdommene innen 2040 vil bli den nest største dødsårsaken i utviklede land. Selv om det finnes ulike behandlinger tilgjengelig for å lindre og håndtere symptomene forbundet med spesifikke sykdommer, er effektive metoder for å bremse eller kurere utviklingen av disse tilstandene fortsatt vanskelige å finne. Nyere studier indikerer et skifte i behandlingsparadigmer fra ren symptomatisk behandling til bruk av cellebeskyttelsesmekanismer for å forhindre ytterligere forverring. Omfattende bevis tyder på at oksidativt stress og betennelse spiller en sentral rolle i nevrodegenerasjon, og posisjonerer disse mekanismene som kritiske mål for cellulær beskyttelse. I de senere år har grunnleggende og klinisk forskning avdekket potensialet til hyperbarisk oksygenbehandling (HBOT) i behandling av nevrodegenerative sykdommer.
Forståelse av hyperbarisk oksygenbehandling (HBOT)
HBOT innebærer vanligvis å øke trykket til over 1 absolutt atmosfære (ATA) – trykket ved havnivå – i en varighet på 90–120 minutter, og krever ofte flere behandlinger avhengig av den spesifikke tilstanden som behandles. Det økte lufttrykket forbedrer tilførselen av oksygen til cellene, noe som igjen stimulerer stamcelleproliferasjon og forsterker helingsprosessene mediert av visse vekstfaktorer.
Opprinnelig var bruken av HBOT basert på Boyle-Marriott-loven, som postulerer den trykkavhengige reduksjonen av gassbobler, i tillegg til fordelene med høye oksygennivåer i vev. Det finnes en rekke patologier som er kjent for å dra nytte av den hyperoksiske tilstanden produsert av HBOT, inkludert nekrotisk vev, stråleskader, traumer, brannskader, kompartmentsyndrom og gassgangren, blant annet oppført av Undersea and Hyperbaric Medical Society. Det er verdt å merke seg at HBOT også har vist effekt som et tilleggsbehandling i ulike inflammatoriske eller infeksjonssykdomsmodeller, som kolitt og sepsis. Gitt sine antiinflammatoriske og oksidative mekanismer, tilbyr HBOT et betydelig potensial som en terapeutisk vei for nevrodegenerative sykdommer.
Prekliniske studier av hyperbarisk oksygenbehandling ved nevrodegenerative sykdommer: Innsikt fra 3×Tg-musemodellen
En av de bemerkelsesverdige studienefokuserte på 3×Tg-musemodellen av Alzheimers sykdom (AD), som viste det terapeutiske potensialet til HBOT i å forbedre kognitive svikt. Forskningen involverte 17 måneder gamle hann-3×Tg-mus sammenlignet med 14 måneder gamle hann-C57BL/6-mus som fungerte som kontrollpersoner. Studien viste at HBOT ikke bare forbedret kognitiv funksjon, men også betydelig reduserte betennelse, plakkmengde og tau-fosforylering – en kritisk prosess assosiert med AD-patologi.
De beskyttende effektene av HBOT ble tilskrevet en reduksjon i nevroinflammasjon. Dette ble dokumentert ved reduksjonen av mikroglial proliferasjon, astrogliose og utskillelsen av proinflammatoriske cytokiner. Disse funnene understreker den doble rollen til HBOT i å forbedre kognitiv ytelse samtidig som den reduserer nevroinflammatoriske prosesser assosiert med Alzheimers sykdom.
En annen preklinisk modell brukte 1-metyl-4-fenyl-1,2,3,6-tetrahydropyridin (MPTP)-mus for å evaluere beskyttelsesmekanismene til HBOT på nevronfunksjon og motoriske evner. Resultatene indikerte at HBOT bidro til forbedret motorisk aktivitet og gripestyrke hos disse musene, noe som korrelerte med en økning i mitokondriell biogenesesignalering, spesielt gjennom aktivering av SIRT-1, PGC-1α og TFAM. Dette fremhever den betydelige rollen mitokondriefunksjonen spiller i de nevrobeskyttende effektene av HBOT.
Mekanismene bak HBOT ved nevrodegenerative sykdommer
Det underliggende prinsippet for bruk av HBOT for ikke-oksidative sykdommer ligger i forholdet mellom redusert oksygentilførsel og mottakeligheten for nevrodegenerative forandringer. Hypoksi-induserbar faktor-1 (HIF-1) spiller en sentral rolle som en transkripsjonsfaktor som muliggjør cellulær tilpasning til lavt oksygentrykk, og har blitt implisert i ulike ikke-oksidative sykdommer, inkludert Alzheimers sykdom, Parkinsons sykdom, Huntingtons sykdom og ALS, noe som markerer den som et viktig legemiddelmål.
Siden alder er en betydelig risikofaktor for flere nevrodegenerative lidelser, er det viktig å undersøke effekten av HBOT på aldringsnevrobiologi. Studier har indikert at HBOT kan forbedre aldersrelaterte kognitive vansker hos friske eldre personer.I tillegg viste eldre pasienter med betydelig hukommelsessvekkelse kognitive forbedringer og økt cerebral blodstrøm etter eksponering for HBOT.
1. HBOTs innvirkning på betennelse og oksidativt stress
HBOT har vist evnen til å lindre nevroinflammasjon hos pasienter med alvorlig hjernedysfunksjon. Det har kapasitet til å nedregulere proinflammatoriske cytokiner (som IL-1β, IL-12, TNFα og IFNγ) samtidig som det oppregulerer antiinflammatoriske cytokiner (som IL-10). Noen forskere foreslår at reaktive oksygenarter (ROS) generert av HBOT medierer flere gunstige effekter av behandlingen. Følgelig, bortsett fra den trykkavhengige boblereduserende effekten og oppnåelsen av høy oksygenmetning i vevet, er de positive resultatene knyttet til HBOT delvis avhengig av de fysiologiske rollene til den produserte ROS-en.
2. Effekter av HBOT på apoptose og nevrobeskyttelse
Forskning har indikert at HBOT kan redusere hippocampal fosforylering av p38 mitogen-aktivert proteinkinase (MAPK), noe som deretter forbedrer kognisjon og reduserer hippocampal skade. Både frittstående HBOT og i kombinasjon med Ginkgo biloba-ekstrakt har vist seg å senke uttrykket av Bax og aktiviteten til caspase-9/3, noe som resulterer i reduserte apoptose-rater i gnagermodeller indusert av aβ25-35. Videre viste en annen studie at HBOT-forkondisjonering induserte toleranse mot cerebral iskemi, med mekanismer som involverer økt SIRT1-ekspresjon, sammen med økte nivåer av B-celle lymfom 2 (Bcl-2) og redusert aktiv caspase-3, noe som understreker HBOTs nevrobeskyttende og anti-apoptotiske egenskaper.
3. HBOTs innflytelse på sirkulasjon ogNevrogenese
Eksponering for HBOT har vært assosiert med flere effekter på det kraniale vaskulære systemet, inkludert økt permeabilitet av blod-hjerne-barrieren, fremme av angiogenese og reduksjon av ødem. I tillegg til å gi økt oksygenforsyning til vev, har HBOTfremmer vaskulær dannelseved å aktivere transkripsjonsfaktorer som vaskulær endotelvekstfaktor og ved å stimulere proliferasjonen av nevrale stamceller.
4. Epigenetiske effekter av HBOT
Studier har vist at eksponering av humane mikrovaskulære endotelceller (HMEC-1) for hyperbarisk oksygen signifikant regulerer 8101 gener, inkludert både oppregulerte og nedregulerte uttrykk, noe som fremhever en økning i genuttrykk assosiert med antioksidantresponsveier.
Konklusjon
Bruken av HBOT har gjort betydelige fremskritt over tid, og bevist dens tilgjengelighet, pålitelighet og sikkerhet i klinisk praksis. Selv om HBOT har blitt utforsket som en off-label behandling for ikke-operative lidelser, og noe forskning har blitt utført, er det fortsatt et presserende behov for grundige studier for å standardisere HBOT-praksis i behandlingen av disse tilstandene. Ytterligere forskning er viktig for å bestemme optimale behandlingsfrekvenser og vurdere omfanget av gunstige effekter for pasienter.
Oppsummert viser skjæringspunktet mellom hyperbarisk oksygen og nevrodegenerative sykdommer en lovende frontlinje innen terapeutiske muligheter, som berettiger fortsatt utforskning og validering i kliniske omgivelser.
Publiseringstid: 16. mai 2025

